肿瘤药物委员会一致同意将MRD做为多发骨髓瘤临床试验加速批准终点
发布时间:2024-05-08 15:33 | 点击次数:553
美国时间4月12日,FDA官网公布了肿瘤药物咨询委员会(ODAC)的会议通告。在此次会议上,委员会全票支持在多发性骨髓瘤(Multiple myeloma,MM)药物研发过程将微小残留病(Minimal residual disease,MRD)作为替代终点指标以加快MM新疗法的批准。
MM是一种恶性血液系统肿瘤,属于发病率较高的血液瘤,主要特征是骨髓中的浆细胞异常增生,是导致造血功能受损、骨破坏和肾功能障碍MM是第二常见的血液恶性肿瘤,约占所有血液恶性肿瘤的17%。
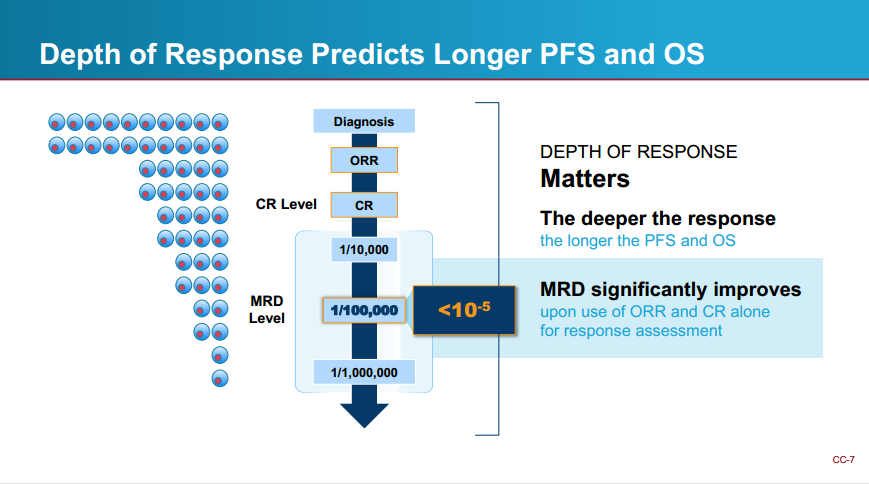
目前MM新药获批终点,主要通过PFS和OS获得常规批准,或者通过ORR作为中间临床终点结合缓解持续时间获得加速批准。但是 MM 治疗的缓解率普遍较高,对于新诊断的 MM 标准治疗已达 90% 以上,难以通过 ORR 准确反映新治疗的获益,而且获得OS,PFS数据以明确疗效的过程的时长太久,因此MM领域急需一个可靠的早期终点。
MRD指在治疗后患者体内仍存在,但常规检测方法无法检出的极少量恶性细胞。目前,MRD是一些常见血液瘤(MM,白血病,淋巴瘤等)的临床常用检测手段,且在多发性骨髓瘤中,国际骨髓瘤工作组(IMWG)已经建立了用于MM的MRD的统一反应标准。
本次ODAC会议围绕两项独立的EVIDENCE和I2TEAMM研究数据进行了分享和讨论。
1. EVIDENCE研究数据分析
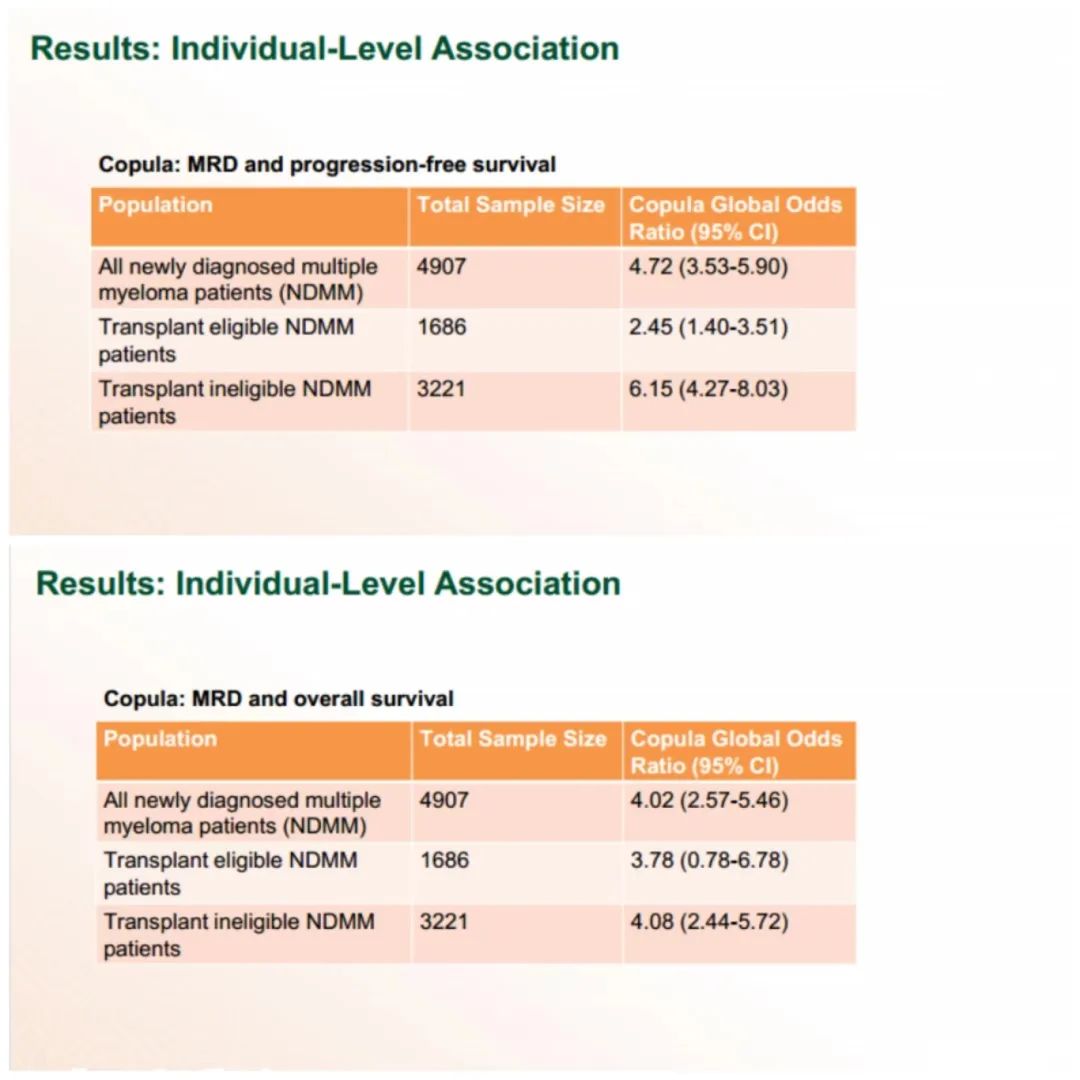
EVIDENCE研究的动机是设计并进行一项基于FDA指导的分析,将MRD的meta分析作为临床终点和加速批准的潜在基础,目的是评估骨髓MRD阴性的预后价值,并预测新诊断多发性骨髓瘤患者临床试验中PFS和OS的治疗效果。该研究结果显示,无论是从患者个体水平还是试验水平对数据进行分析的结果都显示MRD与PFS及OS有良好的相关性,结果表明在新诊断的多发性骨髓瘤患者中,MRD作为早期临床终点能够预测患者的长期预后和临床获益,并且可以用于支持加速审批新疗法。

2. I2TEAMM研究数据分析
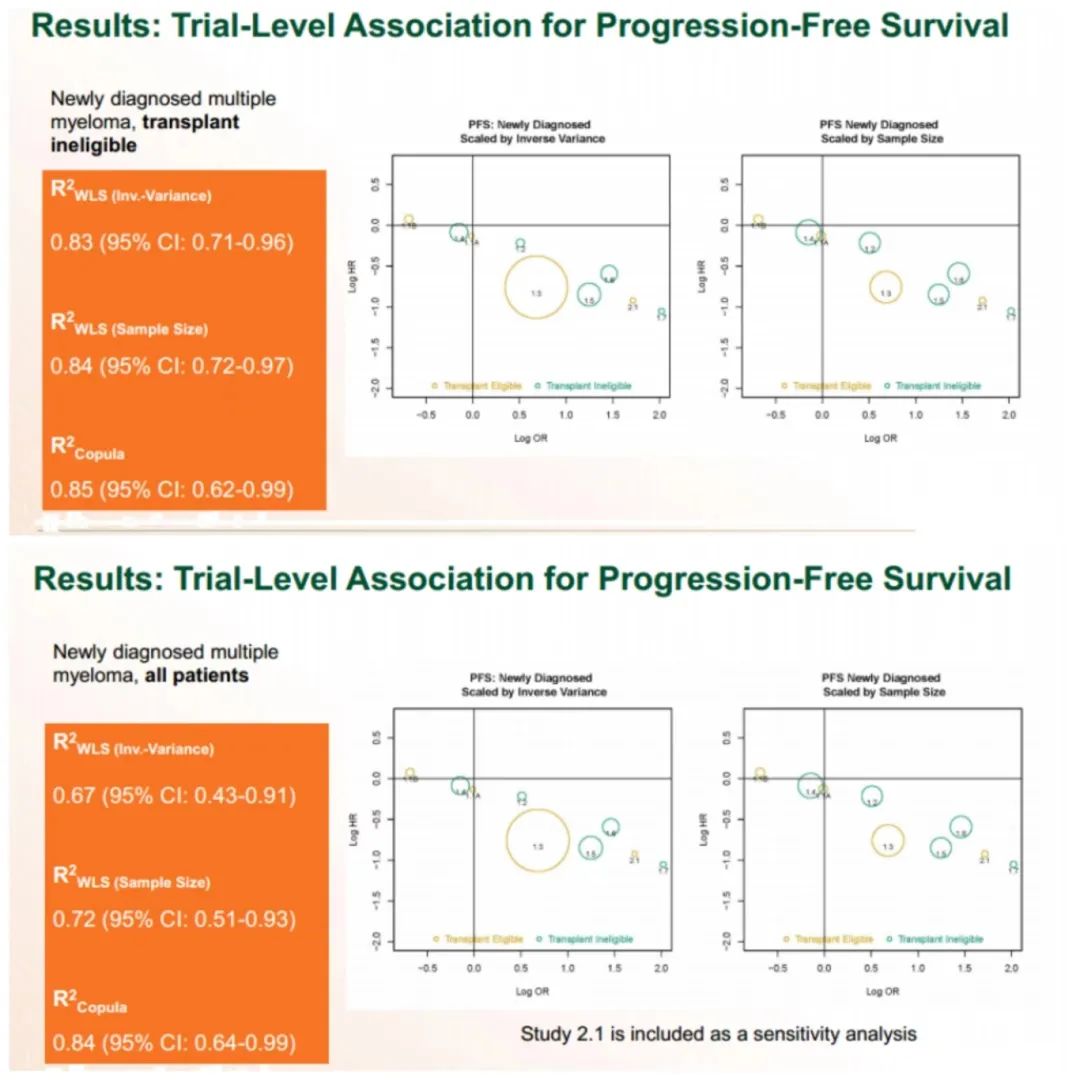
骨髓瘤最小残留病终点批准国际独立小组共纳入20个随机化对照III期试验的数据进行Meta分析,以评估早期 MRD 终点(9 个月及 12 个月 MRD 阴性率)是否能作为预测长期临床获益的早期终点。结果证明了(1)MRD与PFS、OS有良好的相关性(2)MRD检测的灵敏度越高,对预测更有利(3)MRD对PFS和OS有显著影响(4)MRD在所有治疗方式中都表现出与PFS的良好相关性。
该研究结果为MRD能作为预测长期临床获益的早期终点提供了强有力的证据。
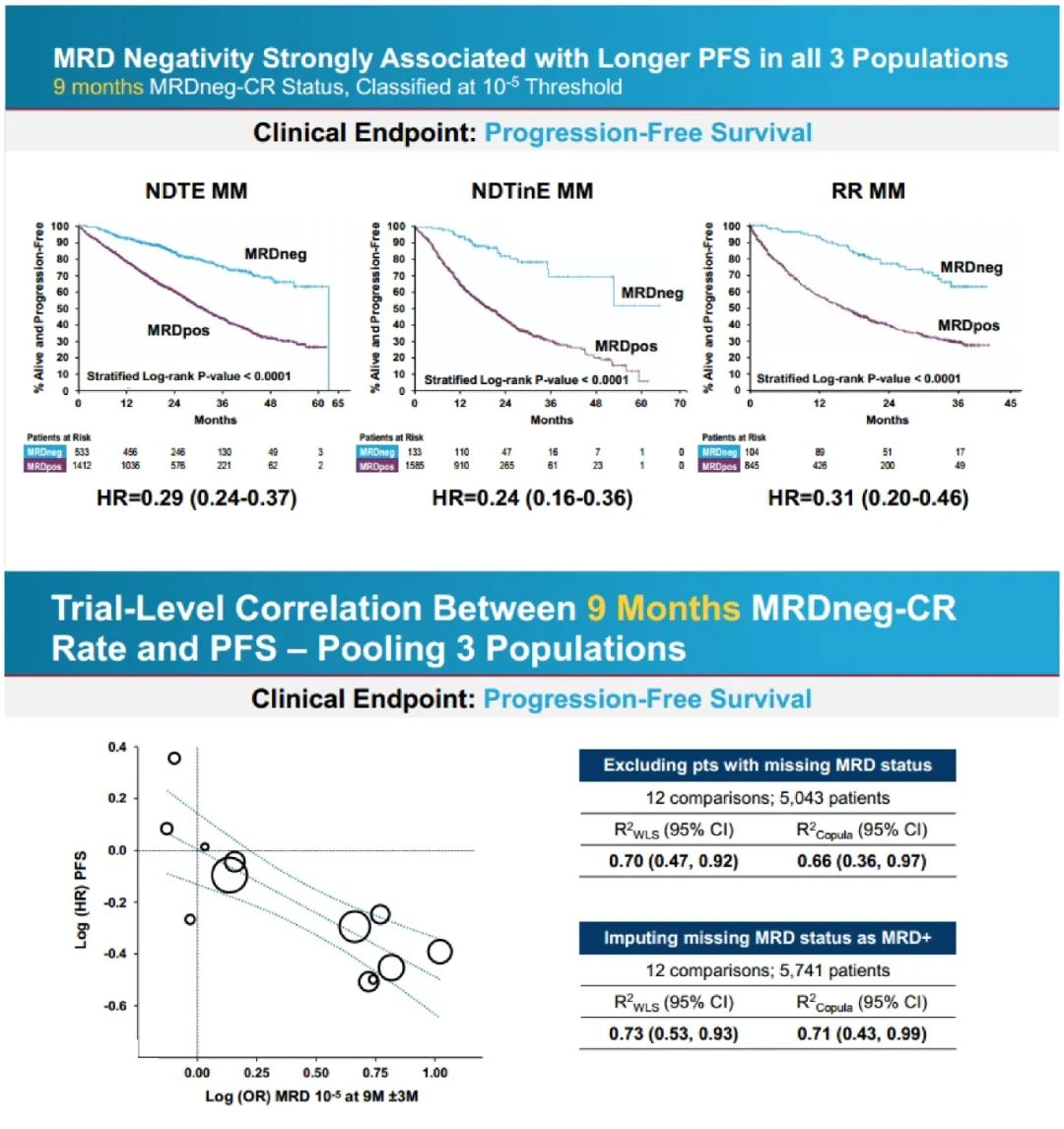
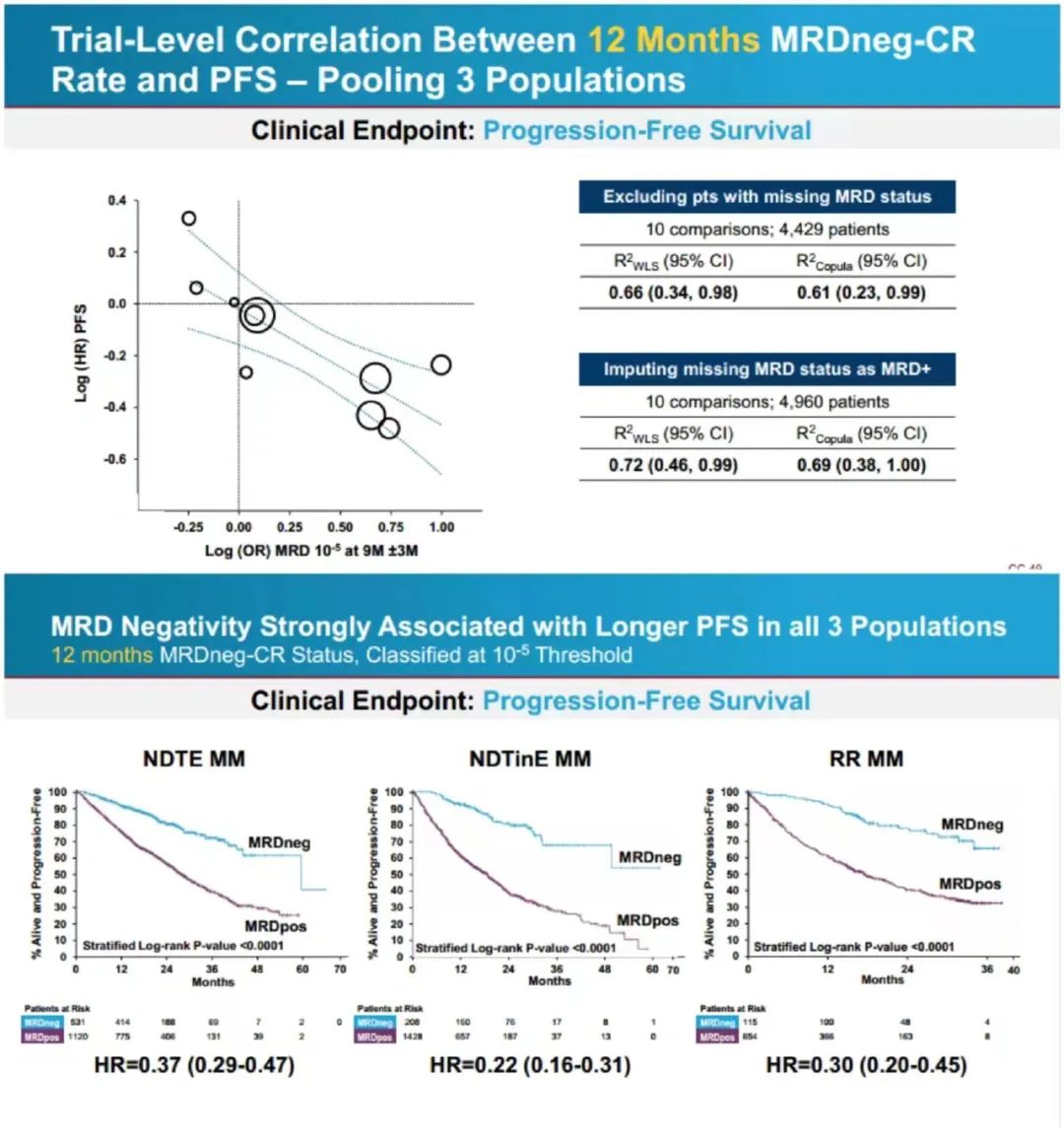
FDA基于两项研究的数据进行进一步分析,结果显示个体患者水平,在所有不同 MM 人群中,9 个月与 12 个月 MRD 阴性与 PFS 和 OS 分别显示出强相关性;试验水平方面,MRD 与 PFS 在多数疾病亚组中显示出弱至中等的相关性,NDTinE 亚组中显示出强相关性;MRD 与 OS 的相关性总体更弱。因此FDA初步认为MRD可以作为支持加速批准的终点,最终12:0全票支持 MRD可作为早期终点,用以多发性骨髓瘤治疗的加速批准。虽然投票结果尚不能代表FDA的最终决定,但鉴于这次会议委员会专家们的全票支持,以及FDA在这次会议前的积极审查,或许MRD很快会被纳入FDA的监管实践之中。
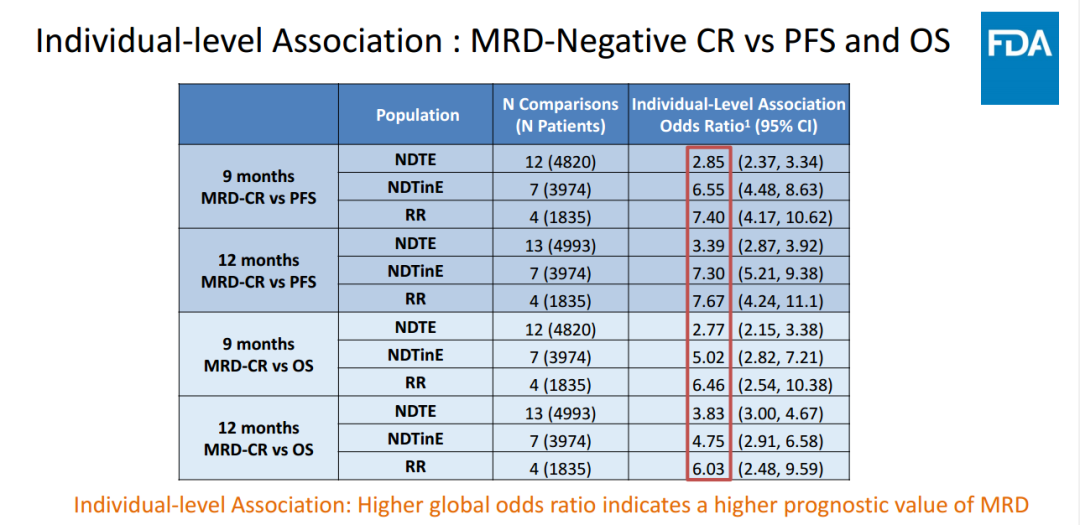
小 结
Seq-MRD®介绍
艾沐蒽是全国率先推出NGS-MRD血液肿瘤微小残留病(MRD)检测Seq-MRD®。Seq-MRD®是基于二代高通量测序技术,通过对患者进行T细胞受体(TCR)或B细胞受体(BCR)高通量测序,从而高准确和高灵敏地对白血病/淋巴瘤/骨髓瘤患者体内微小残留病(MRD)进行检测服务,是专为白血病、多发性骨髓瘤和淋巴癌等血液系统恶性肿瘤的精准诊疗而设计的产品。Seq-MRD®能帮助临床医生预测长期疗效、评估治疗效果、监测缓解状态以及检测早期复发。
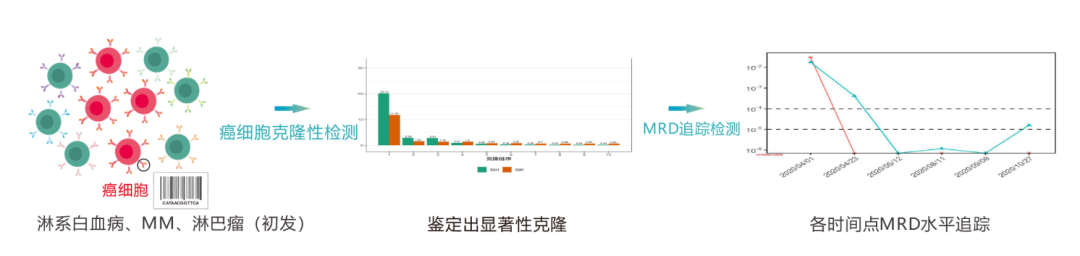
每种B/T淋巴细胞表面均存在一种特异性B细胞受体/T细胞受体,由于BCR/TCR因中V、D、J基因片段重组与碱基的随机插入、删减,导致BCR/TCR具有高度多样性的特点,从而BCR/TCR可作为每个B/T淋巴细胞特有的分子标签。
淋系血液癌症患者因B/T淋巴细胞发生癌变,癌细胞继而自我复制形成克隆性增殖,因此,通过检测B/T淋巴细胞表面受体BCR/TCR可以鉴定癌细胞并追踪检测癌细胞的动态变化。
1.高灵敏度:灵敏度越高,检测深度越深,越能反映真实的MRD水平,与预后相关性也越高。与流式相比,Seq-MRD®的灵敏度高达10-6。
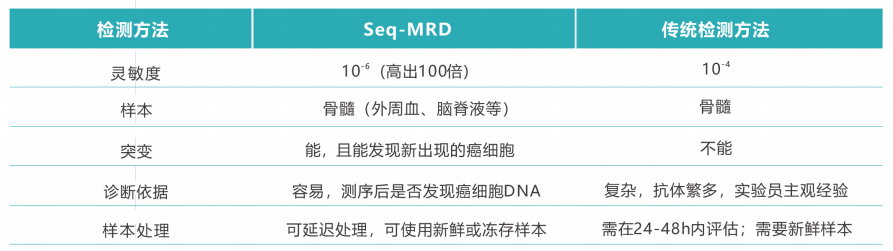
2.实时动态监测:Seq-MRD®能够对患者进行动态、连续的MRD监测,实时评估治疗效果,为临床医生提供及时的反馈,以调整或优化治疗方案,争取实现长期无病生存乃至治愈。
3.广泛适用性:适用于多种类型的血液系统恶性肿瘤,包括但不限于淋系白血病、多发性骨髓瘤等,为不同病种的个体化诊疗提供有力支持。
4.合规与标准化:符合相关监管要求,操作流程可重复,确保检测结果的可靠性和一致性,满足严格的临床试验标准,有利于研究成果的验证和推广。
5.大数据支持:艾沐蒽拥有自主研发的生信学算法,用于筛选和鉴定显著性克隆,提高对癌细胞克隆的独特性识别能力,提升检测的精确度。
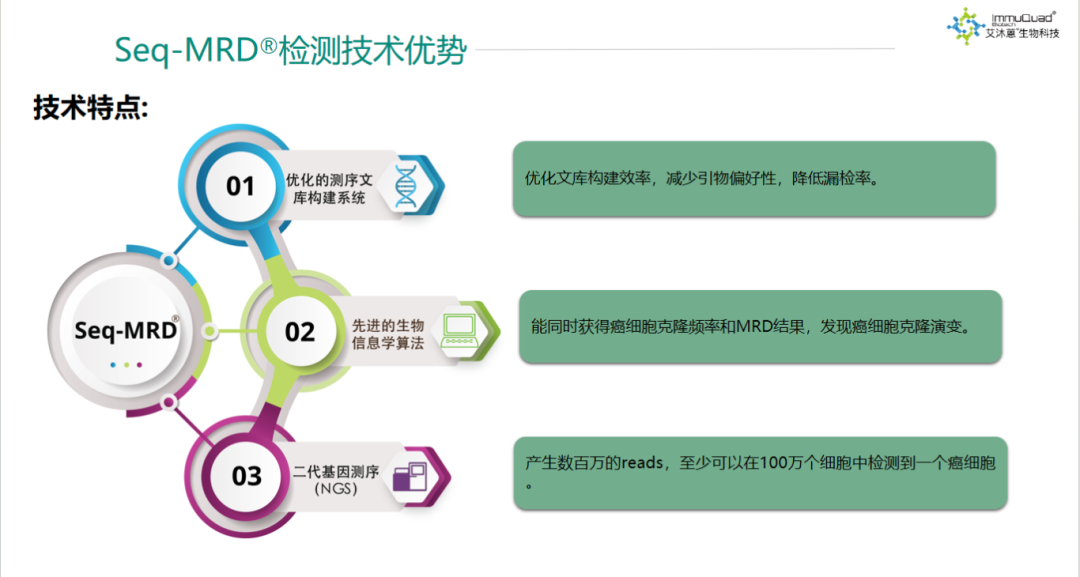
1.癌细胞克隆性检测
通过患者初诊或癌细胞高负荷时的骨髓样本,找到癌细胞特有的DNA“标签”序列。
2.MRD追踪检测
利用筛查出的DNA“标签”序列,在治疗期间或治疗后评估MRD水平,监测癌细胞含量,同时检测识别新出现的癌细胞序列。
1. B系血液系统癌症
急性/慢性B淋巴细胞白血病、多发性骨髓瘤、B型淋巴瘤。
2. T系血液系统癌症
急性/慢性T淋巴细胞白血病、T型淋巴瘤。
1.获得欧盟CE资质认证
Seq-MRD®获得欧盟CE资质(注册号:DE/CA20/01-IVD-Luxuslebenswelt-190/22),获批的是人淋巴B细胞微小残留病基因检测试剂盒(可逆末端终止测序法)。

2.获得三项发明专利
艾沐蒽推出的Seq-MRD®血液癌症MRD检测是最早批实现商业化的产品,自2016年研发专利技术至今,艾沐蒽Seq-MRD®已经获得3项国家发明专利:
[1]“一种应用于高通量测序检测T细胞白血病微小残留病的引物组合及试剂盒”(专 利 号: 2016 11204857.0,授权公告号:CN 106957906 B)
[2]“一种检测微小残留病MRD的试剂盒”(专 利 号: 2018 1 1550133.0,授权公告号: CN 109652518 B)
[3]“一种检测微小残留病MRD的方法”(专 利 号: 2018 1 1549203.0,授权公告号: CN 109680062 B)

3.获得相关软件著作
[1]“免疫组库MRD检测自动化报告系统[简称ImmuReport] V1.0”(登记号:2019SR0916207)
[2]“Seq-MRD检测自动化分析系统(DiscTermite)[简称:DiscTermite]0.4.6“(登记号:2019SR1131517)
[3]“基于免疫组库二代测序的微小残留病(MRD)检测数据处理系统”(登记号:2020SR0507594)

4.获得ISO双标体系认证

5.获得荣誉证书

6.获批IVD一类证
发表相关文献
Seq-MRD®发表相关文献
1、Huang Y, Zhao H, Shao M, Zhou L, Li X, Wei G, Wu W, Cui J, Chang AH, Sun T, Hu Y, Huang H. Predictive value of next-generation sequencing-based minimal residual disease after CAR-T cell therapy. Bone Marrow Transplant. 2022 Jun 1. doi: 10.1038/s41409-022-01699-2. Epub ahead of print. PMID: 35650329.(点击链接可查看文章内容)

2、Chen H, Gu M, Liang J, Song H, Zhang J, Xu W, Zhao F, Shen D, Shen H, Liao C, Tang Y, Xu X. Minimal residual disease detection by next-generation sequencing of different immunoglobulin gene rearrangements in pediatric B-ALL. Nat Commun. 2023 Nov 17;14(1):7468. doi: 10.1038/s41467-023-43171-9. (点击链接可查看文章内容)

3、Min'er Gu,Yahong Xia, Jingying Zhang, Yongmin Tang, Weiqun Xu, Hua Song Xiaojun Xu. The effectiveness of blinatumomab in clearing measurable residual disease in pediatric B-cell acute lymphoblastic leukemia patients detected by next-generation sequencing. Cancer Med. 2023 Dec;12(24):21978-21984. doi:10.1002/cam4.6771.

获得国际市场认可
2023年DelveInsight公司发布的MRD国际市场研究报告中,艾沐蒽/Seq-MRD®是中国独一一家公司/产品进入国际调研市场报告。DelveInsight是一家位于前列的医疗保健市场研究和商业咨询公司,以其现成的联合市场研究报告以及为医疗保健行业的公司提供的定制解决方案而闻名。



ImmunoDiagnostics | ImmunoMonitoring
免疫诊断 | 免疫监控
专注于免疫组高通量测序

长按关注艾沐蒽生物
ImmuHub | Seq-MRD | Immun-Traq
| Immun-Cheq | T-Classifier |TCR-T
Web:www.immuquad.com
Email:Contact@immuquad.com
Tel:0571-81061561
Address:杭州市上城区石桥路196号浙江省农创园
4号楼1层

