产学研实践活动 | 浙大博士科研前沿分享-TCR测序结合AI算法在卵巢癌检测中的应用
发布时间:2024-09-12 17:00 | 点击次数:434
本期分享由艾沐蒽-浙江大学钱塘智慧城社会实践基地的浙江大学医学院2023级毛心齐博士供稿。

标题:高级别卵巢癌患者诊断前血液标本中可量化的TCR组库变化
发表时间:2024年6月
发表期刊:Cell Reports Medicine
影响因子:11.7
研究背景
卵巢癌占女性所有恶性肿瘤的2.5%,导致5%的癌症相关死亡。它包括多种组织学亚型,包括浆液性、黏液性、透明细胞性、子宫内膜样等。高级别卵巢癌(HGOC)以浆液性组织学为主,占新发卵巢肿瘤的70%以上,并导致该疾病的高死亡率。目前的浆液性癌发生模式包括前体病变(STIC)逐渐进展为癌症,并且前体转移至腹腔。遗憾的是,传统方法很少有助于HGOC的早期发现或预防,因此超过87%的病例被诊断为ⅲ期或ⅳ期。
鉴于早期检测卵巢癌的明显临床益处,已在大规模前瞻性筛查试验中评估了无创检测法,重点是血清CA-125水平及其随时间的变化、血清人附睾蛋白和经阴道超声。由于HGOC在进展晚期之前主要由显微镜下病变组成,现有的血液生物标志物或肿瘤影像学检查在检测早期卵巢肿瘤方面可能缺乏敏感性。
作者之前的研究表明,早期癌症可诱导血液T细胞受体(TCR)库发生可观察到的变化。由于免疫组库的巨大多样性给在大样本队列中检测这些信号带来了挑战,作者之前开发了基于几何等长的TCR对齐算法(GIANA)来进行等长嵌入,用于快速TCR聚类。尽管GIANA包埋有助于发现与疾病相关的TCR,但与不同的TCR长度不兼容,因此在生物学上不相关。
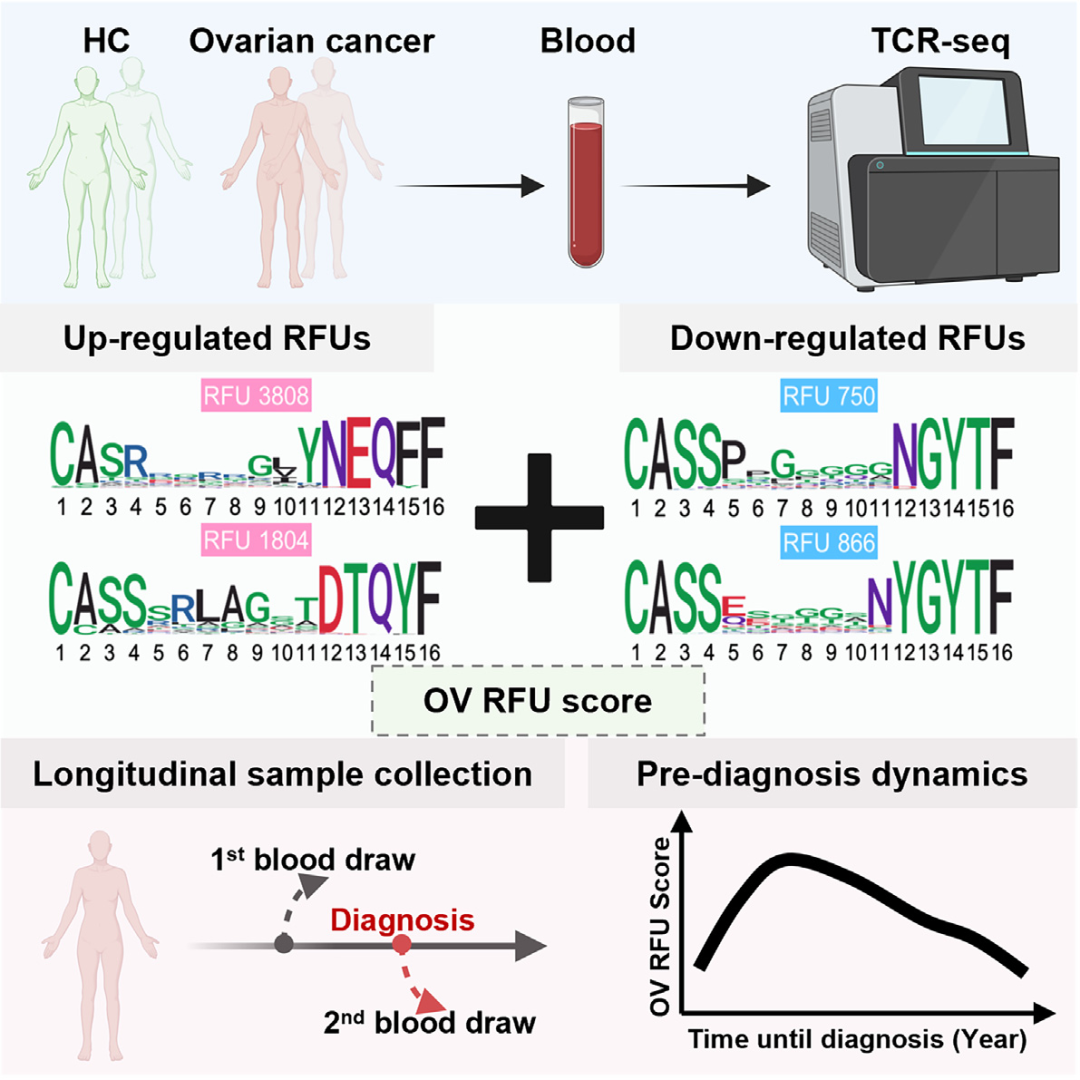
研究方法
作者引入了一种基于序列相似性的三聚体嵌入框架来统一编码不同长度的TCR,从而实现对TCR组库数据的定量分析。随后,作者收集了卵巢肿瘤患者的术前血液样本,以确定与良性卵巢肿瘤患者相比,HGOC患者中富集的TCR单位。最后,作者使用一项大型纵向队列研究和匹配对照的样本,测定了抽取血液后5年内诊断为卵巢癌的患者诊断前血液样本中的TCR。
研究结果
Part 01
TCR的三聚体嵌入和“保留功能单位" (RFU)
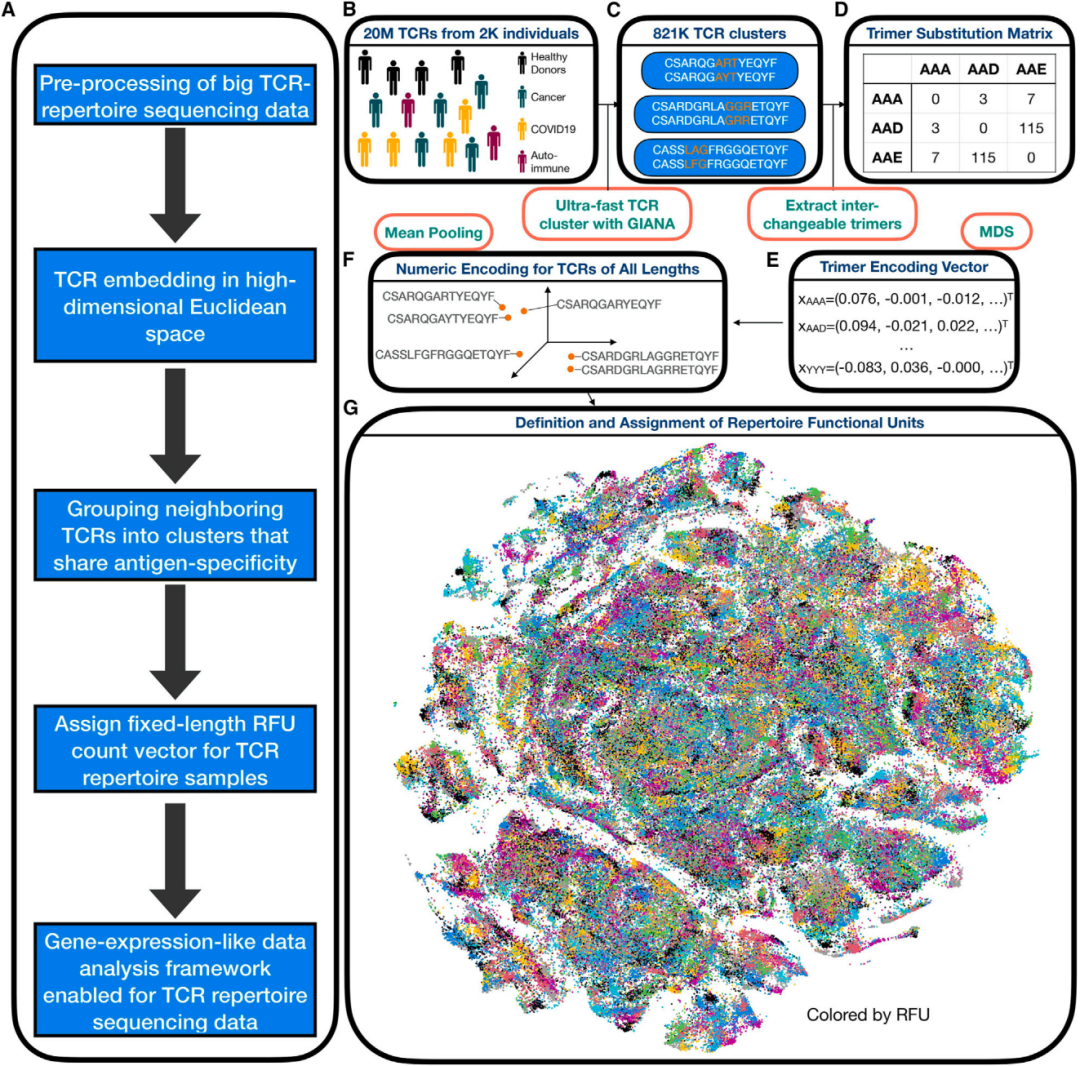
图1
为了定量分析TCR组库数据,作者首先获得了保留氨基酸序列相似性的β链互补决定区3 (CDR3β)区域的数字嵌入(图1A)。简而言之,GIANA基于可变基因(TRBV)和CDR3b序列(图1B)对来自公共领域的约2,000万个TCR进行了聚类,以构建三聚体置换矩阵(图1C和1D)。使用多维尺度获得每个三聚体的近似等长嵌入(图1E),每个CDR3b的最终嵌入向量是通过氨基酸序列中所有连续三聚体的平均汇集来计算(图1F)。作者随后将TCR空间分为5,000组(图1G),超过84%的TCR位于与质心0.018欧氏距离内,这是基准试验中90%特异性的临界值(图S1F)。组中心定义为"保留功能单位" (RFU)。根据这一定义,分配到每个RFU的TCR有90%的机会识别相同的抗原,因此RFU可被视为抗原识别库意义上的“基因”。在研究中,作者将每个TCR库样本转换为一个固定长度的数值向量,即每个RFU的标准化TCR计数,从而将复杂的免疫组库数据转化为可量化的形式,进一步用于疾病状态的分析和预测。
Part 02
HGOC患者的TCR谱图
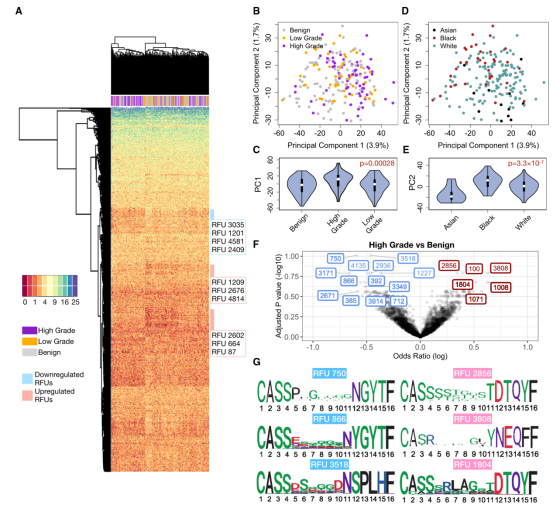
图2
作者前瞻性地收集了213例女性的术前外周血单个核细胞样本的发现队列,包括67例高级别浆液性癌患者、49例其他类型的组织学类型(均为低级别)和97例良性卵巢肿瘤患者,获得每个样本的TCR组库测序数据。使用最可变的1,500个RFU(按标准差排序)可视化了所有213例患者的TCR库,以获得不同疾病组的RFU分布概述。无监督的层次聚类显示HGOC和良性样本之间存在可区分的分离(图2A),提示这两种疾病之间的免疫组库存在总体差异。RFU矩阵的主成分分析(PCA)证实,PC1部分受疾病类别驱动(图2B和图2C)。
相反,PC2受种族影响,非裔美国患者与亚裔患者的差异最大(图2D和图2E)。为了系统地研究HGOC患者和良性患者之间的TCR谱组差异,并确定RFUs是HGOC的独立标志物,作者对全部1,500个RFUs进行了针对患者年龄和种族的logistic回归,并在错误发现率(FDR)≤0.2的情况下观察到显著结果(图2F)。然后,作者观察了HGOC患者中最高上调/下调的CDR3基序(图2G)。在RFU 1804的第6 到9位,作者发现一个保守的“RLAG”模式。具有"RLAG模式的CDR3s与特定的结合基因TRBJ2-3*01(DTQYF)结合,能够识别黑色素瘤抗原MART-1的ELAGIGLTV表位。据报道,MART-1在卵巢肿瘤中表达。这些结果表明,与良性对照相比,HGOC患者的血液库中所选择的RFUs发生了显著改变。
Part 03
RFU是HGOC的危险标志物
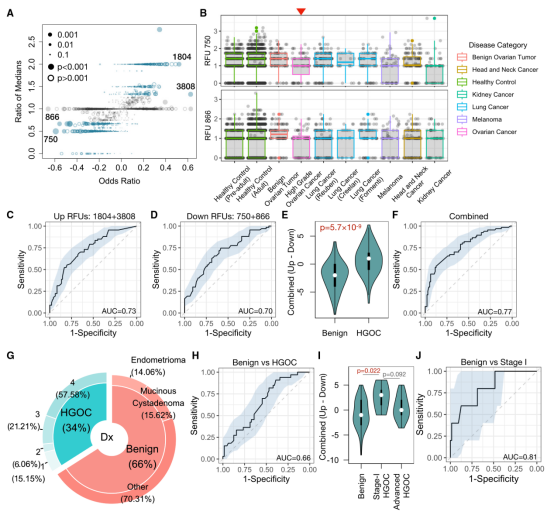
图3
接下来作者选择了一个RFUs子集来评估HGOC的风险。首先,作者观察到,尽管一些RFUs在Logistic回归中达到了较高的比值比(OR),但这些RFUs的中位水平在HGOC患者和良性患者之间无差异(图3A),这提示了参数分析中离群值的潜在影响。去除这些RFUs后,作者根据ORs定义了最高的2个上调和下调的RFUs,包括RFUs 750、866、3808和1804。除了HGOC, RFU 750在黑色素瘤和肾癌中也下调,其中RFU 866显示出类似但不显著的趋势(p = 0.24)(图3B)。
然后,作者测试了4种RFUs作为HGOC对抗良性卵巢肿瘤的潜在风险预测指标的性能。作者直接使用下调RFUs(750和866)或上调RFUs(3808和1804)的总数作为预测指标,观察到中等的预测准确性,AUC略高于0.7(图3C和图3D)。作者使用上调的RFU减去下调的RFU和(1804 + 3808866 - 750)来组合信号,作为“OV RFU评分”。正如预期的那样,HGOC组的这一评分显著高于良性组(图3E), AUC改善为0.77(图3F)。
为了评估这一评分的可重复性,作者收集了一个独立的验证队列,其中包括33例HGOC患者和64例良性患者(图3G)。所有患者术前均采集血液样本进行TCR-seq数据生成。作者直接应用上述4种RFU标记并计算OV RFU评分。将HGOC患者与良性患者区分开来的准确性较低(AUC = 0.66)(图3H)。然而,与发现队列不同,验证队列包括5份ⅰ期HGOC患者样本(表S3)。作者研究了ⅰ期肿瘤内RFU评分的分布,观察到评分显著高于对照(图3I)。作为预测因素,与对照相比,I期HGOC的RFU评分达到了0.81的AUC(图3J)。有趣的是,晚期HGOC的评分低于I期肿瘤,但由于样本量小,没有达到统计学意义。这些结果表明,TCR库可能经历非线性动态变化,并在卵巢恶性肿瘤的早期进展中达到峰值,这一发现在早期卵巢癌检测中具有应用前景。
Part04
卵巢癌患者诊断前样本的短暂TCR谱变化
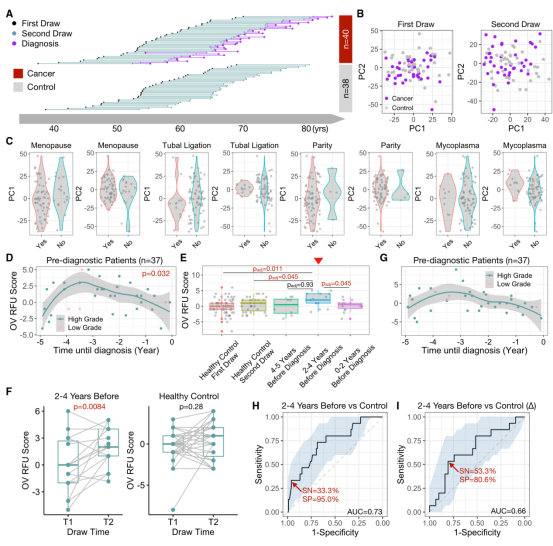
图4
由于I期患者诊断时非常罕见,因此使用更多的HGOC样本进行进一步评估具有挑战性。为了解决这一问题,作者使用了从护士健康研究(Nurses’ Health Studies, NHS/NHSII)收集的血液样本。作者还分析了作者还分析了第1次和第2次抽血时年龄匹配的38名健康对照(图4A)。所有156例NHS样本的TCR序列均使用与发现和验证队列相同的商业平台进行测序。鉴于在ⅰ期HGOC患者中观察到较高的RFU评分(图3I),作者假设在常规诊断前5年内,当肿瘤仍处于早期阶段时,适应性免疫组库可能发生一过性变化。
首先,第1次抽血的所有样本的PCA图显示,癌症患者(确诊前10 ~ 15年)与健康对照之间无差异。在第2次抽血时,PC2有轻微但不显著的差异(p = 0.17,图4B),这表明癌症诱导的变化是微妙的,并没有驱动TCR库的整体变化。接下来,作者研究了已知卵巢癌危险因素33,34对免疫组库的影响。癌症患者和对照组在绝经状态、输卵管结扎、产次或支原体感染方面无差异,所有p值均超过0.05(图4C)。为了避免潜在的混杂效应,作者在下游分析中删除了所有有卵巢癌家族史的受试者。
作者进一步研究了OV RFU评分在诊断前样本中的动态变化。在第2个时间点,作者直接计算了37例通过筛选的卵巢癌患者使用上述4种RFU的RFU评分。有趣的是,RFU评分在诊断前(5 ~ 0年)显示出显著的非随机(p = 0.032)动态曲线,与作者的预期相符(图4D)。具体来说,得分在5 ~ 4年迅速上升,在3年左右达到峰值,然后缓慢下降,直到确诊时。作者根据曲线形状将这一时期分为三个区间:上坡(5 ~ 4)、峰值(4 ~ 2)和下坡(2 ~ 0)。将各组的RFU评分与健康对照的评分进行直接比较,发现峰值组显著高于对照队列的两个时间点(图4E)。
对癌症队列和对照队列的两个时间点进行采样,使作者能够跟踪TCR组库随时间的变化。与匹配的第1个时间点相比,4 ~ 2年时间窗内患者的RFU评分显著增加,而健康个体的RFU评分保持稳定(图4F)。两个时间点RFU评分的增加值(用“D”表示)呈非线性趋势(图4G)。随后作者评估OV RFU评分作为一种潜在的生物标志物,在卵巢癌常规诊断之前检测卵巢癌。如果在4 ~ 2年时间窗内追踪疾病,则RFU评分的AUC将达到0.73,灵敏度为33%,特异度为95%(图4H)。相比之下,时间点之间的增量(D)表现更差(图4I),可能是因为10年期间TCR库的随机波动降低了信噪比。这些结果支持了作者假设,即在卵巢癌的早期发展过程中TCR谱发生了短暂但强烈的免疫变化。
研究结论
高级别卵巢癌(HGOC)是女性死亡的主要原因。早期发现HGOC通常可以治愈,但超过90%的HGOC是在晚期确诊的,这是一个临床挑战。这主要是因为传统的生物标志物不够敏感,不能检测到显微镜下仍有转移的早期病变。在这项研究中,作者对466例卵巢癌患者和对照者的血液T细胞受体(TCR)库进行了测序,并系统地研究了HGOC中的免疫库标签。作者在HGOC中观察到可量化的特定TCR变化,这些变化在多个独立队列中可重复。重要的是,这些变化在第一阶段更强。使用来自护士健康研究(Nurses’Health Study)的诊断前患者血液样本,作者证实,在常规诊断前4年,血液TCR库中可以检测到HGOC信号。
综上所述,卵巢肿瘤进展会导致血液TCR库发生可观察到的变化,这些变化在HGOC更有可能治愈的早期阶段更强。因此,基于免疫的方法可能在2~4年时间窗内检测卵巢癌方面具有优势。
艾沐蒽生物开发的TCR/BCR ImmuHub®测序平台,分别针对DNA和RNA开发了一套检测产品,通过多重PCR或RACE的方法进行扩展和建库,其中RNA+5'RACE建库方法引入UMB(Unique Molecular Barcoded Index,独立分子条形码)进行文库构建。这可对后续PCR扩增或测序过程中的错误进行有效纠正,还原真实的数据,有效杜绝PCR扩增错误和测序错误,从而提高结果准确率。可以为卵巢癌在TCR方面的研究提供更多帮助。


ImmunoDiagnostics | ImmunoMonitoring
免疫诊断 | 免疫监控
专注于免疫组高通量测序
ImmuHub | Seq-MRD | Immun-Traq
| Immun-Cheq | T-Classifier |TCR-T
Web:www.immuquad.com
Email:Contact@immuquad.com
Tel:0571-81061561

