产学研实践活动 | 浙大博士科研前沿分享-TCR测序助力罕见疾病机制的研究
发布时间:2025-01-03 11:39 | 点击次数:312
本期分享由艾沐蒽-浙江大学钱塘智慧城社会实践基地的浙江大学2020级医学院钟世通博士供稿

题目:Guillain–Barré综合征(格林-巴利综合征)中自身反应性T细胞靶向外周神经
发表期刊:Nature
发表时间:2024年1月
影响因子:50.5
格林-巴利综合征(GBS)是一种罕见且可能危及生命的外周神经系统疾病,通常由事先的感染引发,其会导致肌无力、腱反射丧失,有时还会引起呼吸衰竭和自主神经功能障碍。急性炎性脱髓鞘性多发性神经病(AIDP)是欧洲和北美最常见的GBS形式,主要损伤髓鞘和施旺细胞成分,而在急性运动轴索神经病(AMAN)则影响兰氏结中的神经轴突膜。虽然GBS被认为是一种自身免疫性疾病,但其不同临床亚型的机制仍不清楚。
本期分享的这项研究探讨了格林-巴利综合征(GBS)的自身免疫机制。研究发现,GBS患者中存在具有靶向外周神经髓鞘抗原的自身反应性记忆CD4+T细胞和罕见CD8+T细胞,其中CD4+T细胞具有细胞毒性T辅助1型(TH1)表型。研究通过单细胞RNA测序和T细胞受体(TCR)测序,揭示了这些自身反应性T细胞的特征,包括多克隆TCR库、较短的CDR3β长度、易受HLA-DR限制和对免疫优势表位的识别。研究还发现,这些自身反应性TCRβ克隆型在不同GBS患者的血液和脑脊液中共享,但在对照个体中不存在。最后,作者在一名患者的神经活检中鉴定出髓鞘反应性T细胞,表明这些细胞直接参与疾病的病理生理学。这些发现为GBS的免疫机制提供了新的视角,并具有潜在的生物医学应用影响。
1.GBS患者中存在特异性的自身反应性T细胞
作者采用了体外筛选、单细胞RNA测序(scRNA-seq)、单T细胞克隆生成和TCR测序的方法,对AIDP患者(n=15,包括非COVID-19和COVID-19后GBS,病期包括急性期和恢复期)、AMAN患者(n=4)、遗传性脱髓鞘性Charcot–Marie–Tooth病(CMT,腓骨肌萎缩症)1型(CMT1;n=5)患者和健康供体(其中一些有SARS-CoV-2感染史,非COVID-19 HD,n=15;COVID-19后HD,n=6)中的T细胞免疫进行了研究。
通过荧光激活细胞分选(FACS)和共培养实验,研究发现大多数AIDP患者的血液中存在PNS髓鞘反应性记忆CD4+T细胞和罕见的记忆CD8+T细胞,而在AMAN患者、CMT1患者和健康供体中,这些细胞并不常见。
从图1a,b中可以看到,有12名AIDP患者的自身反应性记忆CD4+T细胞靶向一种或多种PNS髓鞘抗原(即外周髓鞘蛋白0(P0)、外周髓鞘蛋白2(P2)和外周髓鞘蛋白22(PMP22)),但在健康供体中基本不会出现靶向(21名中有2名除外)。
从图1c可以看到,在非COVID-19 GBS患者中,P2和P0是急性期主要的自身抗原,而在恢复期,自身反应性CD4+T细胞对所有三种PNS髓鞘抗原的反应显著增加。值得注意的是,COVID-19后GBS患者的CD4+T细胞在阴性对照培养物(无抗原)中表现出高背景增殖,这也印证了GBS可能由感染引发。
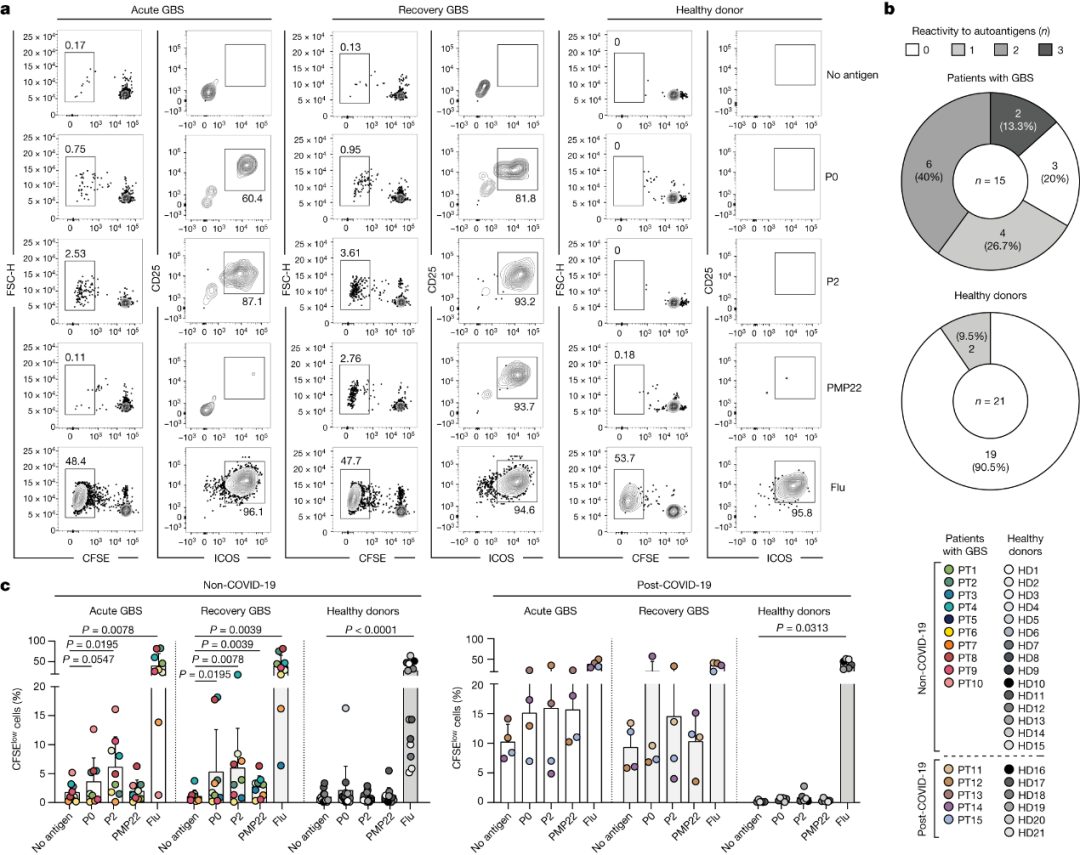
图1
2.自身反应性T细胞克隆表现出相关基因的高表达
为了深入了解AIDP患者中自身反应性CD4+T细胞的表型和TCR库,作者结合了体外刺激、单细胞RNA测序(scRNA-seq)和配对TCRα和TCRβ(TCRα/β)分析等方法进行了分析。作者从两名患者(PT2和PT16)中提取的记忆CD4+T细胞分别用PNS髓鞘抗原(PNS-myelin)或流感抗原(flu)进行体外刺激。
scRNA-seq数据无监督聚类分析揭示了两个不同的簇:一类以增殖和激活基因的高表达为特征(抗原反应性细胞),另一类包含增殖和激活标志物低表达的非反应性T细胞(图2a)。
从图2b可以看到,PNS髓鞘和流感反应性T细胞簇的TH1特征基因都表现出的高表达,而TH2或TH17特征基因都表现为低表达。TH1相关基因仅在抗原反应性细胞簇中富集,而TH2样特征主要在非反应性细胞中发现(图2c)。
值得注意的是,PNS髓鞘反应性细胞显示出比流感反应性细胞显著更高的与细胞毒性相关的基因表达水平(图2d)。基因集富集分析鉴定出PNS髓鞘反应性T细胞中与自身免疫状况相关的基因的富集评分高于流感反应性T细胞(图2e)。
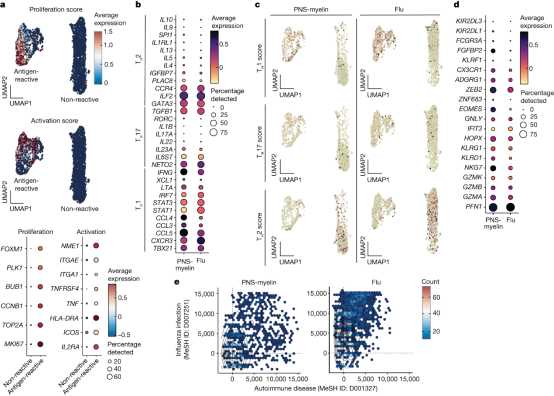
图2
3.自身反应性T细胞克隆的特征
为了进一步研究GBS患者中的自身反应性T细胞反应,作者从13名患者中获得了分别针对P0(n=312)、P2(n=520)或PMP22(n=155)的总计987个CD4+T细胞克隆(图3a),确定了自身反应性T细胞克隆的TCRβ克隆型组成,鉴定出54个P0反应性、88个P2反应性和27个PMP22反应性独特克隆型。此外,也从4名GBS患者的急性期和恢复期血样中分离出来携带相同TCRβ克隆型的P0和P2反应性T细胞克隆(图3b)。
分析表明,自身反应性CD4+T细胞克隆均显示出多克隆TCR库(图3c)。
作者评估了人类白细胞抗原(HLA)II类中和抗体(HLA-DR、HLA-DP或HLA-DQ)对特异性CD4+T细胞克隆的增殖的限制,结果发现细胞主要受HLA-DR限制(图3d,e)。同时,作者成功绘制了P0、P2和PMP22特异性TCRβ克隆型的表位特异性,揭示了多个免疫优势区域(图3f)。
此外,作者发现,相比于病毒和细菌特异性或总记忆CD4+T细胞的CDR3β长度,PNS髓鞘反应性CD4+T细胞克隆型的CDR3β长度更短,支持其自身反应性的特征。
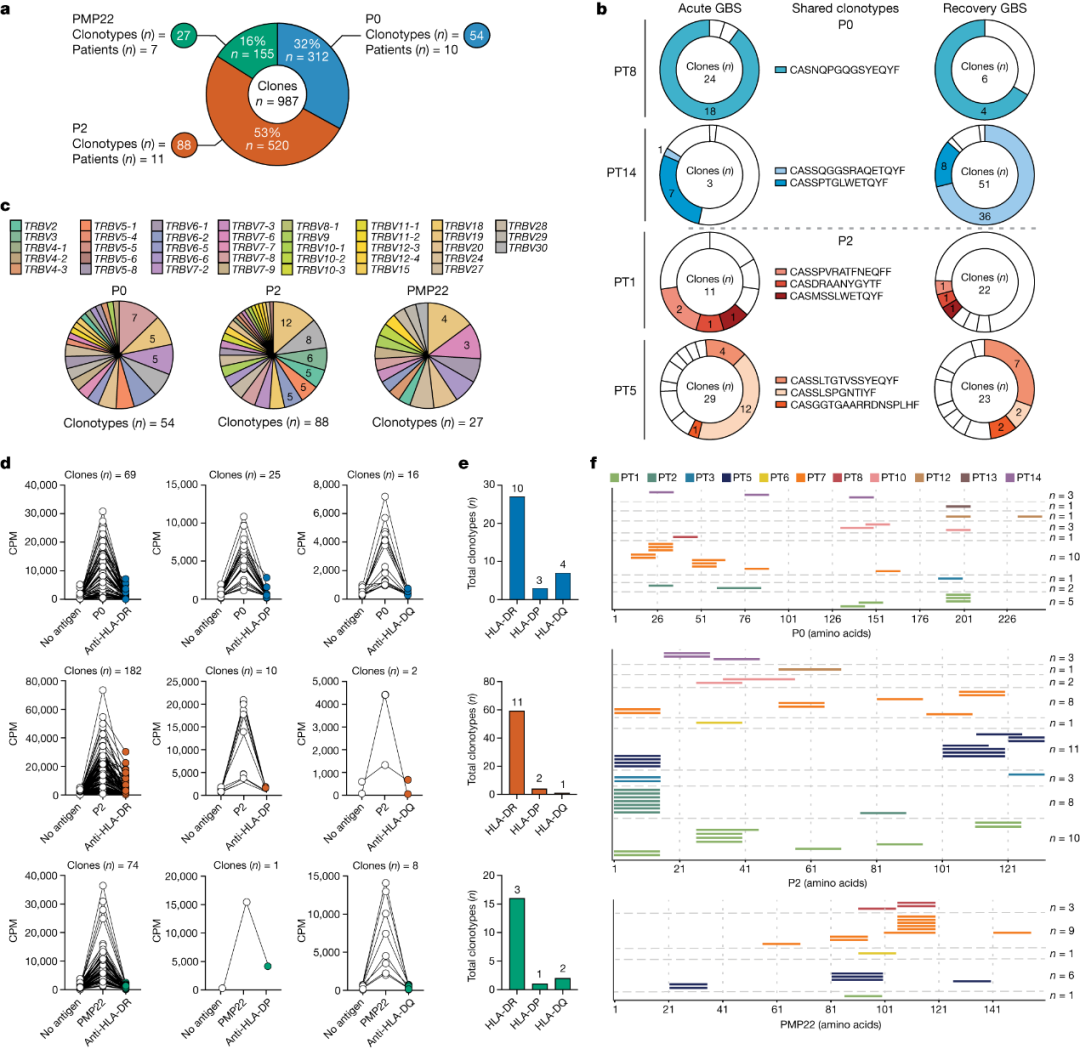
图3
4.TCRβ克隆型在GBS患者中的表现
作者通过高通量TCRβ测序研究了AIDP患者血液中自身反应性T细胞的频率。在几名患者(PT1、PT2、PT4、PT5、PT7和PT12)中,作者鉴定出了与这些患者的PNS髓鞘特异性T细胞克隆相对应的TCRβ克隆型(图4a)。
同时,作者还鉴定出18个在多个AIDP患者(n=6)中共享的PNS髓鞘反应性TCRβ克隆型(图4b),图4c显示了这些克隆型的分布情况。可以看到,在疾病急性期患者中,共享的P0特异性克隆型的累积频率略高于P2和PMP22特异性克隆型(图4d)。
接下来,作者使用“基于表位热点的淋巴细胞相互作用分组”(GLIPH2)算法对AIDP患者的TCRβ克隆型进行了无偏分析,分析鉴定出总共11个TCRβ特异性簇(图4e),其中仅有簇1在九名患者和九名健康供体中共享。但是簇1在克隆型数量或累积频率方面与健康供体相比未显示出特定的富集(图4f,g)。
这些发现确认了在AIDP患者疾病发作和恢复期血液中的自身反应性记忆CD4+ T细胞的存在,并鉴定了在AIDP个体中公共的和独有的自身反应性TCRβ克隆型。
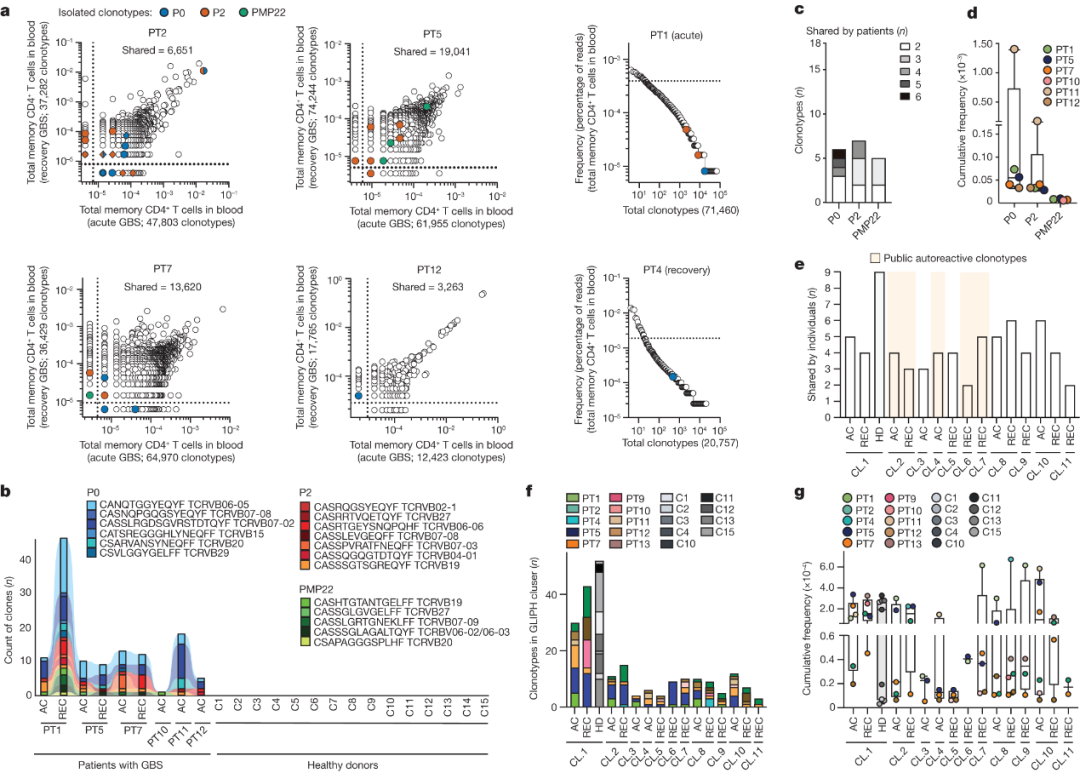
图4
5.CSF和外周神经中的自反应性
为了研究接近组织免疫病理学的自反应性T细胞,作者在AIDP发病初期从三名患者中获得了脑脊液(CSF)样本,通过高通量TCRβ测序进一步富集和表征了脑内CD4+T细胞的克隆型组成(图5a),其中两名患者的CSF中鉴定出了PNS髓鞘特异性克隆型。在PT11的CSF中鉴定出的11个自反应性克隆型中的6个,也在其血液中发现(图5b)。不过,在发表的嗜睡症患者脑内CD4+细胞的TCRβ数据集中没有检测到任何PNS髓鞘特异性克隆型。
最后,作者从一名AIDP发病初期的患者(PT16)中获得了神经活检样本。体外多克隆扩增后,通过体外筛选分析了神经浸润的CD4+T细胞的抗原特异性,发现存在针对P0和PMP22的T细胞(图5c)。作者进一步研究了这一患者血液中的中央记忆(CM)CD4+T细胞群体和效应记忆(EM)CD4+T细胞群体的自身反应性,显示在两个群体中均存在PNS髓鞘反应性T细胞(图5d)。
在神经活检样本和血液中的PNS髓鞘反应性T细胞中,作者鉴定出共享的10个独特TCRβ克隆型,揭示了血液中自身反应性T细胞与神经组织之间的关系(图5e)。
之后,作者使用GLIPH2算法分析了患者(PT16)的神经浸润的CD4+T细胞、患者(PT16)血液中的PNS髓鞘特异性CD4+T细胞和AIDP患者CSF中的总CD4+T细胞的TCRβ克隆型库,鉴定出一个GLIPH2簇和一个公共的PMP22特异性克隆型(图5f)。
这些结果提供了PNS髓鞘反应性T细胞在受影响的神经组织和CSF中存在的证据,表明它们可能参与AIDP的免疫病理学。
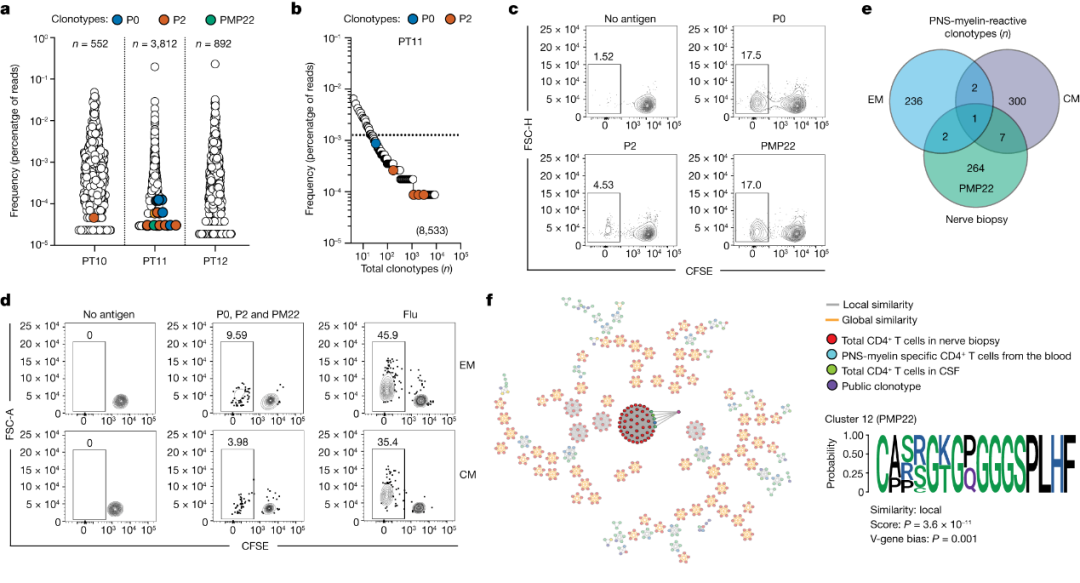
图5
总结
总体而言,研究结果表明,某些病毒感染诱导了细胞毒性PNS髓鞘反应性CD4+T细胞的激活,这些细胞浸润外周神经,导致局部炎症和其他免疫细胞的募集,随后导致髓鞘不稳定、表位扩展和自身免疫反应的扩大。
总之,研究结果提供了对AIDP患者自身反应性T细胞免疫的全面描述,增加了对GBS免疫病理学基本机制的理解,为新的医疗干预以防止疾病进展、降低发病率和死亡率提供了方向。


ImmunoDiagnostics | ImmunoMonitoring
免疫诊断 | 免疫监控
专注于免疫组高通量测序
ImmuHub | Seq-MRD | Immun-Traq
| Immun-Cheq | T-Classifier |TCR-T
Web:www.immuquad.com
Email:Contact@immuquad.com
Tel:0571-81061561

